식품의약품안전처는 26일 국내 유통 중인 메트포르민 원료 및 완제의약품 NDMA(비의도적 불순물)를 검사한 결과 원료의약품은 잠정관리기준 이하로, 완제의약품 일부는 기준을 초과했다고 밝혔다.
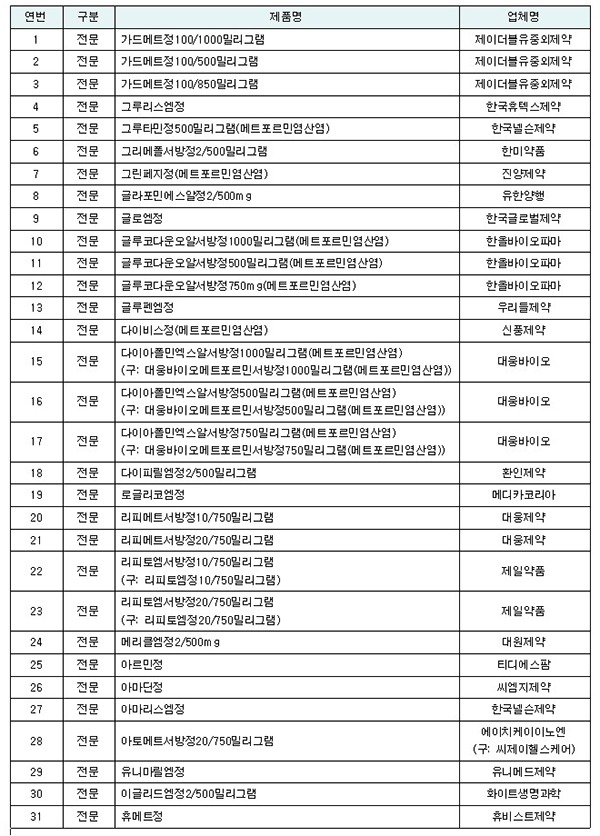
이에 288개 완제의약품 전체 중 31개 완제의약품에서 NDMA가 잠정관리기준을 초과 검출됨에 따라 이들 제품에 대해 잠정 제조 판매 및 처방중지를 결정했다.
다만 이번에 검출된 31품목은 추가로 암이 발생할 가능성은 매우 낮은 수준(10만명 중 0.21명)으로, 식약처는 의·약사 상담 없이 임의로 복용을 중단하지 말 것을 당부했다.
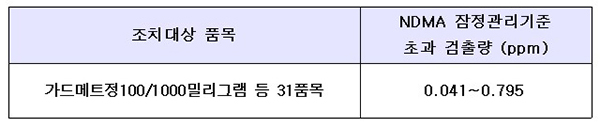
이번에 검사를 진행한 메트포르민은 식이요법과 운동요법으로 혈당조절이 충분히 이루어지지 않는 당뇨병 환자의 치료에 사용되는 의약품 성분이며, NDMA(N-니트로소디메틸아민)는 WHO 국제 암연구소(IARC)가 지정한 인체 발암 추정물질(2A)이다.
하지만 전문가의 인체영향평가 결과 NDMA가 잠정관리기준을 초과하여 검출된 메트포르민 의약품을 장기간 복용하였더라도 인체에 미치는 위해 우려는 거의 없으므로 현재 처방받은 의약품 복용을 임의로 중단해서는 안된다.
식약처는 “재처방을 희망하는 환자분은 해당 의약품의 복용여부 및 재처방 필요성을 의료진과 상담하여 주시기 바란다”고 밝혔다.
한편 식약처는 지난 2019년 11월부터 비의도적 불순물(NDMA 등) 안전관리 대책을 추진하며 국내 제조에 사용 중인 원료의약품, 제조 및 수입완제의약품 수거·검사 등 조사 실시해왔다.
또한 업체가 자체적으로 시험할 수 있도록 메트포르민 중 NDMA를 검출할 수 있는 시험법을 마련하고, 지난 1월 공개하기도 했다.
그동안의 검사 결과, 실제 완제의약품 제조에 사용된 원료의약품 973개 제조번호(12개 제조소) 모두 NDMA가 잠정관리기준(0.038ppm) 이하인 것으로 확인되었는데, 이중 963개는 불검출이며 10개는 정량한계(0.010ppm) 수준(0.010∼0.016ppm)이 검출됐다.
이번 결과에 대해 보건복지부는 의료기관, 약국에서 잠정 제조·판매중지 된 의약품이 처방·조제되지 않도록 조치했다고 밝혔다.
아울러 26일 0시부터 해당 의약품이 의료기관, 약국에서 처방·조제되지 않도록 건강보험심사평가원 의약품안전사용정보시스템(DUR)을 통해 처방·조제를 차단하고, 건강보험 급여 적용도 정지했다.
이번에 잠정 판매중지 및 처방제한 의약품 목록은 ▲식품의약품안전처(http://www.mfds.go.kr) 또는 의약품안전나라(http://nedrug.mfds.go.kr), 블로그(http://mfdsblog.com), 페이스북(http://www.facebook.com/mfds) ▲한국의약품안전관리원(http://www.drugsafe.or.kr) ▲보건복지부(http://www.mohw.go.kr), 검색포털사이트 등에서 확인할 수 있다.
<저작권자 ⓒ 치안경찰신문, 무단 전재 및 재배포 금지>
치안경찰 / 유풍식 기자 기자 다른기사보기





